- Grundlegende Sicherheits- und Leistungsanforderungen (GSPR)
Anhang-XVI-Produkte müssen die grundlegenden Sicherheits- und Leistungsanforderungen gemäß Anhang I der MDR erfüllen. Im Gegensatz zu Medizinprodukten mit medizinischer Zweckbestimmung müssen sie jedoch keinen klinischen Nutzen nachweisen. Stattdessen gilt:
- Nachweis von Sicherheit und Leistung (nicht von medizinischem Nutzen)
- Risiko-Akzeptanz: Für Anhang-XVI-Produkte sind schwere Schäden grundsätzlich nicht akzeptabel, da kein medizinischer Nutzen besteht, der Risiken rechtfertigen könnte.
- Gemeinsame Spezifikationen (Common Specifications)
Am 1. Dezember 2022 wurden die Gemeinsamen Spezifikationen (Common Specifications, CS) durch die Durchführungsverordnung (EU) 2022/2346 veröffentlicht. Sie sind verbindlich und konkretisieren die Anforderungen an Anhang-XVI-Produkte:
- Anhang I der CS: Allgemeine Anforderungen für alle Anhang-XVI-Produkte (Risikomanagement, Sicherheitsinformationen, Kennzeichnung, Gebrauchsanweisung)
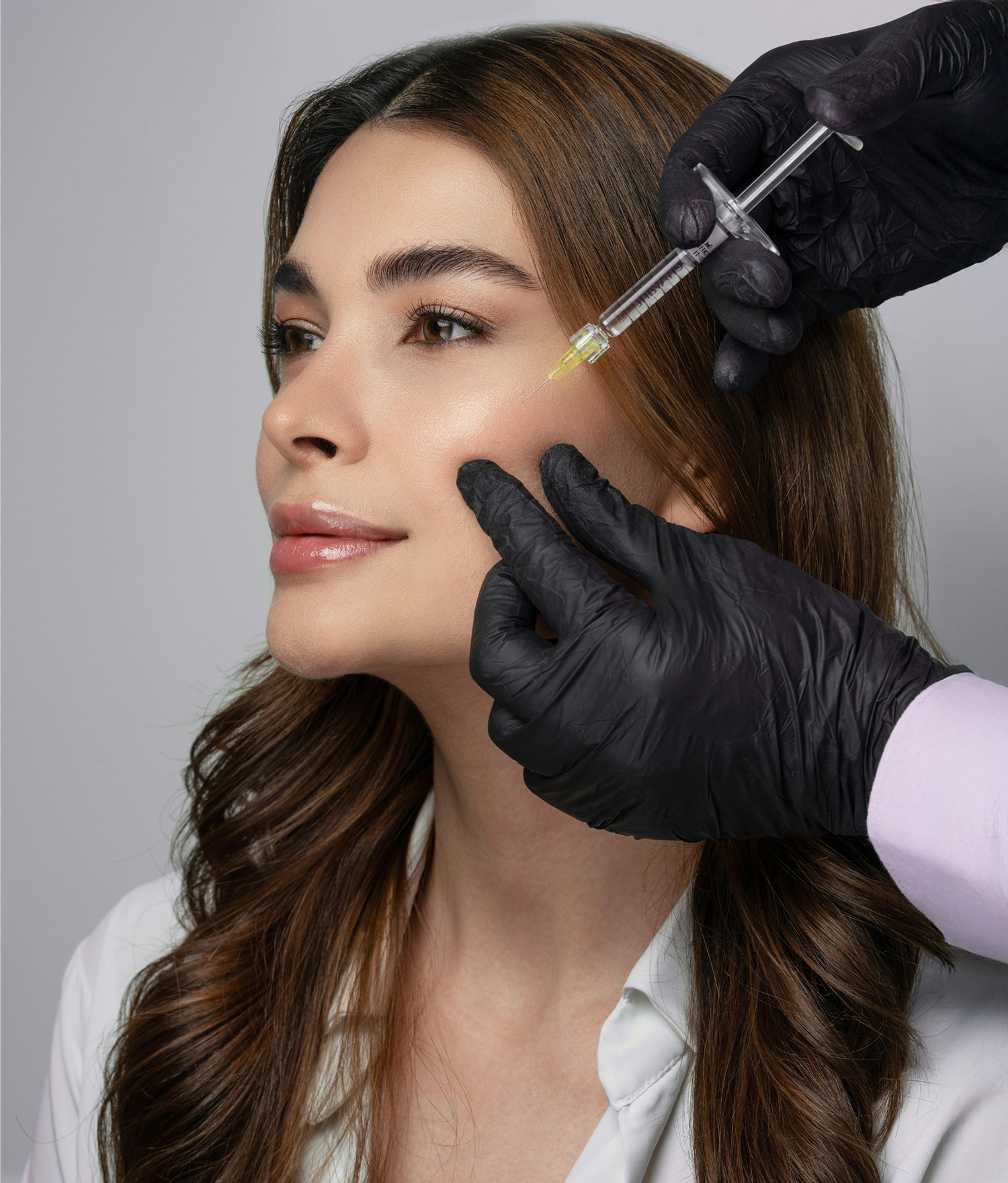
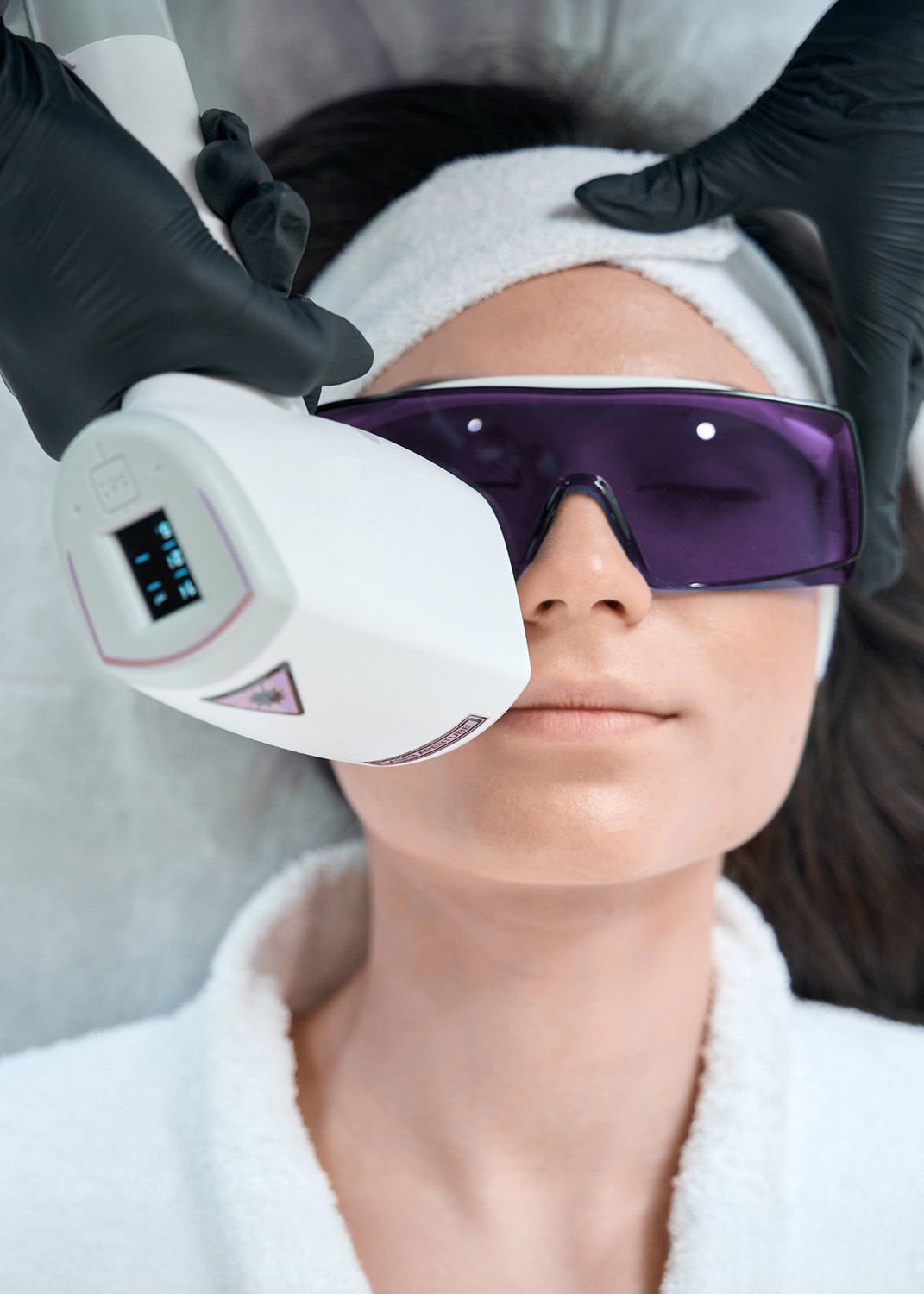
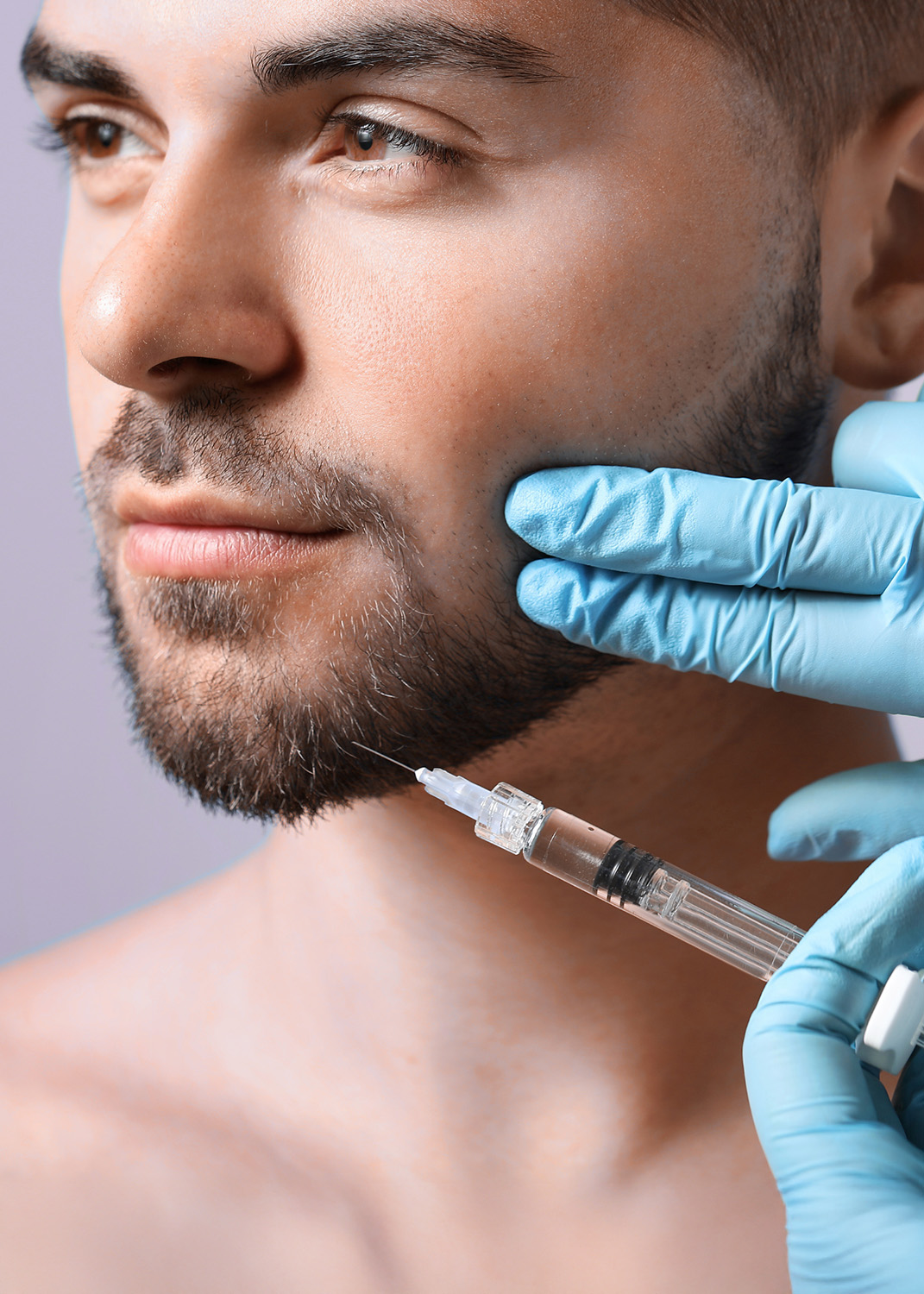
- Anhänge II–VII der CS: Produktgruppenspezifische Anforderungen (z. B. für Kontaktlinsen, Implantate, Dermal Filler, Fettabsauggeräte, Laser-Hautbehandlung, TMS-Geräte)
Die Common Specifications sind seit 22. Juni 2023 anwendbar.
- Klinische Bewertung
Anhang-XVI-Produkte benötigen eine klinische Bewertung, jedoch keine klinische Prüfung, wenn ein analoges Medizinprodukt existiert und die Gleichwertigkeit nachgewiesen werden kann. Analog bedeutet laut den Common Specifications: ein Produkt mit medizinischer Zweckbestimmung, das in Funktion, Risikoprofil und technischen Merkmalen vergleichbar ist.
Wichtig: Anhang-XVI-Produkte dürfen keinerlei medizinische oder therapeutische Wirksamkeit beanspruchen. Jede Heilaussage würde das Produkt automatisch zu einem Medizinprodukt mit medizinischer Zweckbestimmung machen – und damit wären die Anhang-XVI-Regelungen nicht mehr anwendbar.
- Klassifizierung und Konformitätsbewertung
Anhang-XVI-Produkte werden gemäß den Klassifizierungsregeln in Anhang VIII der MDR eingestuft. Da die Regeln 9 und 10 (für aktiv therapeutische und diagnostische Produkte) eine medizinische Zweckbestimmung voraussetzen, wurden durch die Durchführungsverordnung (EU) 2022/2347 spezielle Reklassifizierungen für aktive Anhang-XVI-Produkte vorgenommen:
- Hautbehandlungsgeräte mit elektromagnetischer Strahlung (z. B. Laser, IPL): Klasse IIb
- Haarentfernungsgeräte (Laser, IPL): Klasse IIa
Je nach Risikoklasse ist eine Konformitätsbewertung durch eine Benannte Stelle erforderlich. Die Konformitätsbewertungsverfahren entsprechen denen für klassische Medizinprodukte (Artikel 52 MDR).
- Qualitätsmanagementsystem (QMS)
Hersteller von Anhang-XVI-Produkten müssen ein Qualitätsmanagementsystem gemäß MDR Artikel 10 errichten und implementieren. Dazu gehören:
- Risikomanagement-System (ISO 14971)
- Post-Market Surveillance (PMS)
- Vigilanz und Meldepflichten bei Vorkommnissen
- Technische Dokumentation
- Verantwortliche Person (Person Responsible for Regulatory Compliance, PRRC)
- Kennzeichnung und Gebrauchsanweisung
Anhang-XVI-Produkte müssen klar als „ohne medizinische Bestimmung” gekennzeichnet sein. Die Kennzeichnung und Gebrauchsanweisung müssen die Anforderungen der MDR und der Common Specifications erfüllen.